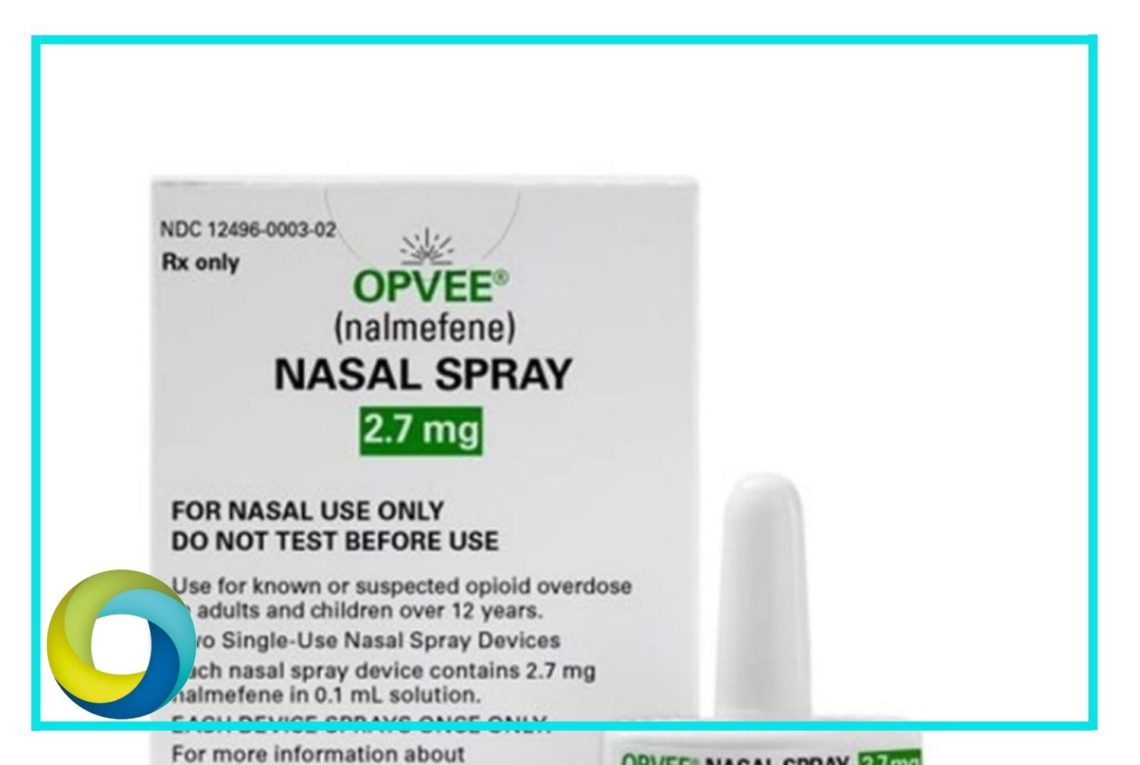
La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos anunció este martes la aprobación del primer aerosol nasal de clorhidrato de nalmefeno para el tratamiento de emergencias por sobredosis de opioides en adultos y pacientes pediátricos de 12 años o más. Esta aprobación representa un paso importante en la lucha contra la crisis de opioides que afecta al país.
El aerosol, comercializado bajo el nombre de Opvee, es fabricado por la farmacéutica Opiant y administra 2.7 miligramos de nalmefeno directamente en la cavidad nasal. Este medicamento está disponible únicamente mediante receta y ha sido diseñado para su uso tanto en entornos de atención médica como en comunidades afectadas por el abuso de opioides, brindando así una opción de tratamiento más accesible y rápida en situaciones de emergencia.
Sin embargo, la FDA advierte sobre posibles reacciones adversas al utilizar este compuesto. Algunos efectos secundarios reportados incluyen molestias nasales, dolores de cabeza, náuseas, mareos, vómitos, ansiedad, fatiga, irritación de la garganta, disminución del apetito, enrojecimiento de la piel y sudoración excesiva. Es importante que los pacientes consulten a su médico y sigan las indicaciones y advertencias proporcionadas en la etiqueta del producto.


















Sé el primero en comentar