La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) autorizó el uso de emergencia de la primera prueba rápida para detectar el coronavirus que se puede hacer en casa y da resultados en 30 minutos, cumpliendo así una medida para ampliar los métodos de diagnósticos ante la pandemia.
Desde la FDA, que anunció la medida hoy, informaron que es un paso importante para las alternativas de pruebas en un país que lidera el número de contagios y muertes en el mundo por coronavirus.
La prueba requerirá prescripción médica, lo que probablemente limitará su uso inicial, después de que el organismo regulador de medicamentos de Estados Unidos autorizó el kit de emergencia de un solo uso de Lucira Health, una fabricante de California.
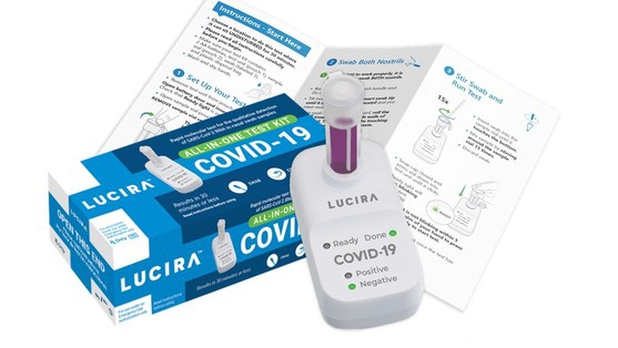
Esta prueba permite a los usuarios tomarse ellos mismos una muestra nasal. Después se frota el hisopo nasal en un vial con una solución de laboratorio que se conecta a un dispositivo portátil. Los resultados se muestran como luces de colores identificadas como positiva o negativa.
Lucira no respondió en un primer momento a una petición de detalles adicionales, enviada tras el final de su horario laboral el martes.
El sistema de Lucira se desarrolló a partir de las investigaciones de la empresa para un test casero de gripe, según el sitio web de la compañía. Lucira adaptó su tecnología para detectar el covid-19 tras el brote.
La prueba utiliza una tecnología similar a las que se utilizan en laboratorios, basadas en información genética que son la herramienta estándar para detectar el nuevo coronavirus.
En cambio, la mayoría de los exámenes rápidos que se utilizan ahora en Estados Unidos buscan proteínas virales llamadas antígenos, y no al virus en sí.



















Sé el primero en comentar